Premeny skupenstiev
Poznáme 4 skupenstvá: pevné, kvapalné, plynné a plazma. O plazme sa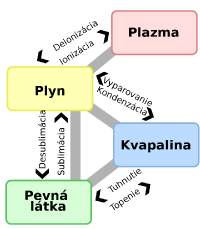 na základnej škole neučí, takže sa budeme venovať len trom základným skupenstvám. Vlastnosti látok v daných skupenstvách som rozoberal v príspevku Základy fyziky. V tomto príspevku sa budeme zaoberať premenami skupenstiev. Schéma na obrázku vpravo ukazuje, ako sa premeny skupenstiev nazývajú. Keďže sa na základných školách neučí o plazme, nebudem v tomto príspevku rozoberať ionizáciu ani deionizáciu.
na základnej škole neučí, takže sa budeme venovať len trom základným skupenstvám. Vlastnosti látok v daných skupenstvách som rozoberal v príspevku Základy fyziky. V tomto príspevku sa budeme zaoberať premenami skupenstiev. Schéma na obrázku vpravo ukazuje, ako sa premeny skupenstiev nazývajú. Keďže sa na základných školách neučí o plazme, nebudem v tomto príspevku rozoberať ionizáciu ani deionizáciu.
Vyparovanie
Vyparovanie je premena kvapaliny na plyn. Vyparovanie prebieha za každých podmienok (akákoľvek teplota, tlak atď.). Je to endotermický proces (spotrebúva teplo).
Rýchlosť vyparovania závisí od teploty, veľkosti povrchu kvapaliny a odstraňovania pár nad povrchom kvapaliny. Tieto závislosti využívame v aj bežnom živote, napríklad vypraté oblečenie nenechávame na kope ale rozkladáme ho na sušiak (aby mal čo najväčší povrch) alebo umyté vlasy ,,fénujeme" (čiže prefukovaním vzduchu odstraňujeme pary a keďže je horúci, aj zvyšujeme teplotu). Rôzne kvapaliny sa vyparujú rôznou rýchlosťou (napríklad benzín sa vyparuje rýchlejšie ako voda).
Kvapalina sa môže vyparovať buď len zo svojho povrchu, alebo v celom objeme. Vyparovanie v celom objeme sa nazýva var.
Var
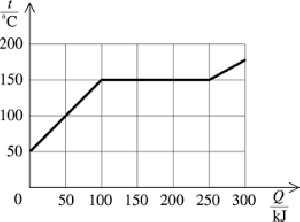 Var je intenzívne vyparovanie vody. Pri vare sa kvapalina vyparuje v celom svojom objeme. To neznamená, že po dosiahnutí teploty varu sa celá kvapalina okamžite vyparí. To znamená, že sa nevyparuje len z povrchu, ale na rôznych (náhodných) miestach nádoby. Navonok sa to prejaví tvorbou bubliniek (,,bublaním"). Počas varu sa teplota sústavy nemení. Je to z toho dôvodu, že všetko dodané teplo sa spotrebúva na proces odparovania, ktorý potrebuje energiu. Na grafe závislosti teploty od dodaného tepla sa to prejaví zlomom. Čiže keď kvapaline dodávame teplo, jej teplota spočiatku stúpa. Keď dosiahneme teplotu varu, systém ostáva pri tejto teplote, aj keď dodávame ďalšie teplo. Až keď sa všetka kvapalina premení na paru, začne pri ďalšom dodávaní tepla teplota systému (ktorý je teraz tvorený už len čistou parou) znovu stúpať.
Var je intenzívne vyparovanie vody. Pri vare sa kvapalina vyparuje v celom svojom objeme. To neznamená, že po dosiahnutí teploty varu sa celá kvapalina okamžite vyparí. To znamená, že sa nevyparuje len z povrchu, ale na rôznych (náhodných) miestach nádoby. Navonok sa to prejaví tvorbou bubliniek (,,bublaním"). Počas varu sa teplota sústavy nemení. Je to z toho dôvodu, že všetko dodané teplo sa spotrebúva na proces odparovania, ktorý potrebuje energiu. Na grafe závislosti teploty od dodaného tepla sa to prejaví zlomom. Čiže keď kvapaline dodávame teplo, jej teplota spočiatku stúpa. Keď dosiahneme teplotu varu, systém ostáva pri tejto teplote, aj keď dodávame ďalšie teplo. Až keď sa všetka kvapalina premení na paru, začne pri ďalšom dodávaní tepla teplota systému (ktorý je teraz tvorený už len čistou parou) znovu stúpať.
Teplota varu závisí od atmosférického tlaku. Pri zvýšenom tlaku sa zvýši aj teplota varu, ale pozor, táto závislosť nie je rovnomerná (čiže neplatí že koľkokrát sa zvýši tlak, toľkokrát aj teplota varu). Čo je to atmosférický tlak? Okolo našej Zeme je plynný obal, ktorý sa nazýva atmosféra. Plynný obal Zeme siaha do výšky niekoľko sto kilometrov nad jej povrch. Na čiastočky plynného obalu pôsobí Zem príťažlivou silou. Horné vrstvy atmosféry Zeme tlačia na spodné vrstvy atmosféry. Toto pôsobenie sa prejavuje tým, že vo vzduchu vzniká tlak. Silové pôsobenie horných vrstiev atmosféry nazývame tlaková sila. Veľkosť tlakovej sily a veľkosť tlaku vzduchu spolu súvisia.
Teplota varu vody je pri normálnom atmosférickom tlaku 100°C.
Počas varu sa aj pri ďalšom dodávaní tepla nemení, až dokiaľ sa všetka kvapalina nepremení na plyn. Plyn už môžeme zohriať aj na vyššiu teplotu.
Ak chceme variť rýchlejšie, logicky potrebujeme vyššiu teplotu. Ale ako to  docieliť, keď kvapalná voda pri normálnom tlaku vrie už pri 100°C a teda sa navyššiu teplotu zohriať nedokáže? Ak však zvýšime tlak, zvýši sa aj teplota varu vody. Na tom princípe funguje tlakový hrniec (Papinov hrniec). Hrniec je natesno uzavretý pokrievkou a para teda nedokáže uniknúť. Hromadí sa nad vodou a tým nad ňou zvyšuje tlak. Voda teda ostáva kvapalinou aj pri vyššej teplote.
docieliť, keď kvapalná voda pri normálnom tlaku vrie už pri 100°C a teda sa navyššiu teplotu zohriať nedokáže? Ak však zvýšime tlak, zvýši sa aj teplota varu vody. Na tom princípe funguje tlakový hrniec (Papinov hrniec). Hrniec je natesno uzavretý pokrievkou a para teda nedokáže uniknúť. Hromadí sa nad vodou a tým nad ňou zvyšuje tlak. Voda teda ostáva kvapalinou aj pri vyššej teplote.
Kondenzácia
Kondenzácia (inými slovami skvapalňovanie alebo zrážanie) je premena plynu na kvapalinu. Na rozdiel od vyparovania neprebieha za každých podmienok ale iba ak je priestor presýtený parami a súčasne dôjde k ich schladeniu. Teplota, pri ktorej para skondenzuje, sa nazýva rosný bod. Rosný bod závisí od tlaku a stupňa nasýtenia priestoru parou. Kondenzácia je exotermický proces (uvoľňuje teplo).
Topenie a tuhnutie
Topenie je premena pevnej látky na kvapalinu. Je to endotermický proces (spotrebúva teplo). Tuhnutie je proces presne opačný, čiže premena kvapaliny na pevnú látku. Je to exotermický proces (uvoľňuje teplo). Teplota, pri ktorej sa látka topí, sa nazýva teplota topenia a teplota, pri ktorej látka tuhne, sa nazýva teplota tuhnutia. Pre väčšinu látok (teoreticky pre všetky) má teplota topenia rovnakú hodnotu ako teplota tuhnutia. Teplota topenia ľadu (a tuhnutia kvapalnej vody) je pri normálnom tlaku 0°C.
Niektoré látky sa topia pri nižších teplotách (ľad, maslo), ale iné (železo, meď) pri veľmi vysokých. Látky s vysokou teplotou topenia topíme v špeciálnych zariadeniach - vysokých peciach a hovoríme tomu tavenie.
|
Látky sa topia dvomi odlišnými spôsobmi, ktoré závisia od ich štruktúry. Tuhé látky sa podľa svojej štruktúry delia na kryštalické a amorfné (beztvaré). Kryštalické látky (ľad, soli, diamant, grafit, kovy...) majú pravidelnú vnútornú štruktúru, čiže vieme nakresliť tzv. kryštálovú mriežku, čiže schému, podľa ktorej sú častice (molekuly, ióny, atómy) v látke usporiadané. Môžu mať pravidelný tvar aj navonok (vieme si predstaviť napríklad, ako vyzerajú kryštáliky soli). Kryštalické látky majú presne určenú teplotu topenia a topia sa tak, že pri jej dosiahnutí začne ubúdať tuhá látka a pribúdať kvapalina (vieme, ako s topí ľad). |
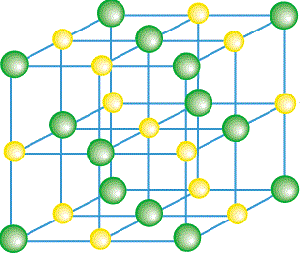  |
Amorfné (beztvaré) látky (čokoláda, parafín, sklo...) nemajú pravidelnú vnútornú štruktúru a správajú sa ako kvapaliny s veľmi veľkou viskozitou. Nevieme presne určiť ich teplotu topenia, len akýsi jej interval (napríklad teplota topenia parafínu je 34°C-56°C). Topia sa úplne odlišným spôsobom. Ak zohrievame kúsok skla, postupne mäkne, ľahko sa ohýba a naťahuje, potom vzniká masa, ktorá sa ťahá ako med, neskôr sa podobá smotane a nakoniec sa zmení na kvapalinu podobnú vode.
Kovy síce tiež pri zahrievaní postupne mäknú a ich pravidelný tvar navonok nevidíme, ale i napriek tomu sú kryštalické, lebo pravidelnú vnútornú štruktúru majú a takisto majú aj presne určenú svoju teplotu topenia.
Závislosť teploty od dodaného tepla pri topení kryštalických látok je analogické s varom. Čiže na grafe sa prejaví zlomom, pred dosiahnutím teploty topenia teplota stúpa, potom je konštantná a po úplnom roztopení znovu stúpa. Iná situácia nastane pri topení amorfných látok. Tam teplota pri dodávaní tepla stále stúpa, na grafe nie je žiaden zlom. Prečo to tak je? Odpoveď je, že z istého pohľadu žiadna skupenská premena nenastane, lebo amorfná látka, aj keď sa nám javí ako pevná, je z istého pohľadu len kvapalina s veľmi veľkou viskozitou (viskozita je to, čomu v bežnej reči hovoríme hustota - že kvapalina sa ,,nerozprskáva" a tečie pomaly). Ak vás zaujíma táto téma, pozrite si článok o jednom z najdlhšie trvajúcich vedeckých experimentov na svete: https://www.interez.sk/toto-je-jeden-z-najdlhsie-trvajucich-experimentov-na-svete-zacal-este-v-roku-1927-trva-dodnes-a-je-online/. Tuhnutie prebieha analogicky, len opačne. Čiže pri kvapalinách, ktoré sú v tuhom skupenstve kryštalické, teplota pri odoberaní tepla najprv klesá, po dosiahnutí teploty tuhnutia je konštantná a po úplnom stuhnutí (kryštalizácii) znovu klesá. Pri amorfných látkach stále klesá.
Väčšina látok sa pri zvýšenej teplote ,,rozťahuje" (čiže zväčšuje svoj objem) a pri zníženej teplote ,,sťahuje" (čiže zmenšuje svoj objem) a teda v kvapalnom skupenstve budú mať väčší objem ako v tuhom. Je to preto, že častice látky sa pri zvýšenej teplote od seba odďaľujú a pri zníženej sa k sebe približujú.
Voda však pri stuhnutí svoj objem, naopak, zväčší a najmenší objem má pri 4°C. Ako je to možné?! Molekuly vody sa pri znížení teploty síce tiež priblížia k sebe, ale vďaka ich tvaru sa usporiadajú veľmi neúsporne (do šesťuholníkov), a tak zaberú viac miesta ako keď sú od seba vzdialené. Tento jav nazývame anomália vody. V prírode je veľmi dôležitý, lebo s rastúcim objemom (hmotnosť sa s teplotou vôbec nemení) klesá hustota. Ľad má teda menšiu hustotu ako kvapalná voda, takže na nej pláva. Keďže je zároveň dobrým izolantom (aj keď sneh je ešte lepším), chráni spodné vrstvy vody pred ochladením a následným zamrznutím. Vodné organizmy teda môžu pod vrstvou ľadu ďalej plávať a prežiť zimu.
Niečo navyše
Fázové rovnováhy
Napadla vám niekedy otázka, prečo odparovanie prebieha za každej teploty, kdežto opačný proces (kondenzácia), len ak je vzduch (plynná fáza) nasýtený vodnou parou a zároveň dôjde k jej schladeniu? Veď predsa keď sú to navzájom opačné procesy, mali by prebiehať za analogických podmienok, nie? Alebo keď teplota varu závisí od tlaku, ako sa táto závislosť dá vyjadriť? A prečo odparovanie z povrchu prebieha za každej teploty, kdežto v celom objeme len pri teplote varu? Na všetky tieto otázky sa pokúsim odpovedať v tejto kapitole.
 Majme fľašu, do ktorej nalejeme vodu (alebo inú kvapalinu), ale nie doplna a potom ju zatvorme. V tejto fľaši sa teda nachádza kvapalné aj plynné skupenstvo. Keďže voda bola len pred chvíľou doliata, vzduch (plynná zložka, fyzikálne správne tzv. plynná fáza) vo fľaši ešte neobsahuje veľké množstvo vodnej pary (len toľko, koľko bolo vo vzduchu v miestnosti, kde sme fľašu otvorili, aby sme doliali kvapalinu). Čo sa začne diať? Voda vo fľaši sa začne odparovať, a teda prechádzať do plynnej fázy. Množstvo vody v plynnej fáze teda bude narastať. Z toho dôvodu začne prebiehať aj kondenzácia (voda zo vzduchu vo fľaši bude naspäť prechádzať do kvapalnej fázy), a so zvyšujúcim sa obsahom vody v plynnej fáze bude zrýchľovať. Na makroskopickej úrovni ale žiadnu kondenzáciu nepozorujeme, a to z toho dôvodu, že odparovanie je zatiaľ stále rýchlejšie. Ako ale kondenzácia zrýchľuje, raz nastane bod, keď sa jej rýchlosť vyrovná s rýchlosťou odparovania. Vtedy sa na makroskopickej úrovni odparovanie zastaví. Na makroskopickej úrovni teda teraz neprebieha žiadna premena skupenstva, na mikroskopickej prebieha ako odparovanie, tak aj kondenzácia, a to rovnakou rýchlosťou. Tento bod sa nazýva fázová rovnováha. Každý systém sa snaží dostať do rovnováhy, a to je vlastne dôvodom, prečo premeny skupenstva (rovnako ako aj iné fyzikálne a chemické procesy) vôbec prebiehajú. Vodná para, ktorá je v rovnováhe s kvapalnou fázou (ako teraz) sa nazýva nasýtená para. Keď našu fľašu teraz zahrejeme, rovnováha sa posunie smerom k plynnej fáze, a teda opäť prevládne odparovanie, až dokiaľ systém nedospeje k tejto novej, posunutej rovnováhe. Keď ju, naopak, ochladíme, rovnováha sa posunie smerom ku kvapalnej fáze a rýchlejšie bude prebiehať kondenzácia, až dokiaľ sa neustáli táto nová rovnováha.
Majme fľašu, do ktorej nalejeme vodu (alebo inú kvapalinu), ale nie doplna a potom ju zatvorme. V tejto fľaši sa teda nachádza kvapalné aj plynné skupenstvo. Keďže voda bola len pred chvíľou doliata, vzduch (plynná zložka, fyzikálne správne tzv. plynná fáza) vo fľaši ešte neobsahuje veľké množstvo vodnej pary (len toľko, koľko bolo vo vzduchu v miestnosti, kde sme fľašu otvorili, aby sme doliali kvapalinu). Čo sa začne diať? Voda vo fľaši sa začne odparovať, a teda prechádzať do plynnej fázy. Množstvo vody v plynnej fáze teda bude narastať. Z toho dôvodu začne prebiehať aj kondenzácia (voda zo vzduchu vo fľaši bude naspäť prechádzať do kvapalnej fázy), a so zvyšujúcim sa obsahom vody v plynnej fáze bude zrýchľovať. Na makroskopickej úrovni ale žiadnu kondenzáciu nepozorujeme, a to z toho dôvodu, že odparovanie je zatiaľ stále rýchlejšie. Ako ale kondenzácia zrýchľuje, raz nastane bod, keď sa jej rýchlosť vyrovná s rýchlosťou odparovania. Vtedy sa na makroskopickej úrovni odparovanie zastaví. Na makroskopickej úrovni teda teraz neprebieha žiadna premena skupenstva, na mikroskopickej prebieha ako odparovanie, tak aj kondenzácia, a to rovnakou rýchlosťou. Tento bod sa nazýva fázová rovnováha. Každý systém sa snaží dostať do rovnováhy, a to je vlastne dôvodom, prečo premeny skupenstva (rovnako ako aj iné fyzikálne a chemické procesy) vôbec prebiehajú. Vodná para, ktorá je v rovnováhe s kvapalnou fázou (ako teraz) sa nazýva nasýtená para. Keď našu fľašu teraz zahrejeme, rovnováha sa posunie smerom k plynnej fáze, a teda opäť prevládne odparovanie, až dokiaľ systém nedospeje k tejto novej, posunutej rovnováhe. Keď ju, naopak, ochladíme, rovnováha sa posunie smerom ku kvapalnej fáze a rýchlejšie bude prebiehať kondenzácia, až dokiaľ sa neustáli táto nová rovnováha.
Teraz už môžeme odpovedať na našu prvú otázku. Prečo teda môže kondenzácia (na makroskopickej úrovni) prebehnúť, len ak je vzduch nasýtený vodnou parou a len ak dôjde k jej ochladeniu? Lebo ak ňou vzduch nie je nasýtený, systém ešte stále nie je v rovnováhe. Rovnováha je stále posunutá k plynnej fáze, a teda prevláda odparovanie. Ak je už vzduch nasýtený, systém je v rovnováhe, a ak chceme vyvolať kondenzáciu, musíme rovnováhu posunúť smerom ku kvapalnej fáze, a to dosiahneme ochladením. Prečo ale potom hovoríme, že odparovnaie (aj na makroskopickej úrovni) prebieha za každej teploty? Nuž, nie je to úplne pravda. Ako som vysvetlil vyššie, neprebieha, ak je systém v rovnováhe, alebo ak je rovnováha posunutá smerom ku kvapalnej fáze. Tu ide o to, že v otvorených systémoch (voda v pohári, vetraná miestnosť, bielizeň sušiaca sa vonku...) je väčšinou rovnováha posunutá smerom k plynnej fáze. Vodná para v (prízemnej) atmosfére väčšinou nie je nasýtená (hovoríme, že je prehriata). Voda z pohára sa nám teda celá vyparí a bielizeň nám vyschne (za každej teploty). Ak sa predsa len stane, že vodná para v prízemnej atmosfére sa stane nasýtenou, a potom sa ochladí a skondenzuje, tak to môžeme pozorovať ako hmlu. Vo vyšších častiach troposféry sa to deje bežne, a takto vzniknuté zhluky vodných kvapiek (prípadne aj kryštálikov ľadu) zmiešaných zo vzduchom pozorujeme ako oblačnosť.
Vznikajúca para (ako každá látka v plynnom skupenstve) pôsobí určitým tlakom. Logicky, čím je pary viac, tým je tento tlak väčší. Maximálny tlak pár za danej teploty bude teda tlak nasýtenej pary (staršie nazývaný aj tenzia pár). Pri zvyšujúcej sa teplote tlak nasýtenej pary narastá. Každá teplota má svoj špecifický tlak nasýtenej pary. Prečo pod teplotou varu prebieha odparovanie len z povrchu? Lebo akonáhle sa voda odparí na inom mieste kvapaliny, musí vzniknúť bublinka (tvorená nasýtenou parou). Atmosférický tlak pôsobiaci na kvapalinu túto bublinku ihneď stláča, a tým núti paru premeniť sa naspäť na kvapalinu. Tlak bublinky musí byť teda dostatočne silný, aby atmosférický tlak prekonal. Var (odparovanie v celom objeme), teda nastane pri takej teplote, pri ktorej sa tlak nasýtenej pary rovná atmosférickému tlaku.
A ako to bude s topením a tuhnutím? Na rozdiel od vodnej pary (ktorá uniká do vzduchu), kryštáliky ľadu (vznikajúce pri mrznutí vody) a vodné kvapôčky (vznikajúce pri topení ľadu), nemajú kam unikať a zostávajú v systéme. Pri posunutí rovnováhy teda okamžite začnú meniť svoje skupenstvo, aby dosiahli túto novú rovnováhu. Preto topenie ani tuhnutie neprebiehajú za každej teploty, ale len za teploty topenia/tuhnutia (tá istá teplota). Bez dodávania alebo odoberania tepla je sústava ľad-voda pri teplote 0°C v rovnováhe. Ak takúto sústavu tepelne izolujeme (napr. dáme do termosky), žiaden ďalší ľad nevznikne, ale žiaden sa ani neroztopí.
Fázový diagram
|
|
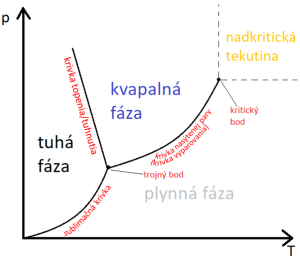
Vzťahy medzi fázovými rovnováhami vyjadruje fázový diagram. Vodorovná os reprezentuje teplotu a zvislá tlak. Z fázového diagramu teda možno odčítať, pri akých kombináciách teploty a tlaku bude látka (ak je v rovnováhe) v danom skupenstve. Krivky reprezentujú skupenské premeny. Krivka medzi tuhou látkou a kvapalinou sa nazýva krivka topenia. Pri kombináciách teploty a tlaku ležiacich na tejto krivke je kvapalné a tuhé skupenstvo v rovnováhe - systém môže byť celý kvapalný, celý tuhý, alebo časťtak a časť tak. Pri dodávaní tepla sa tuhá časť topí. Teplota sa nemení, až dokiaľ nie je všetko roztopené. Pri odoberaní tepla kvapalná časť tuhne a teplota sa opäť nemení, až dokiaľ nebude všetko v tuhom skupenstve. |
Ak sústavu tepelne izolujeme (napríklad dáme do termosky), nebude sa meniť ani množstvo ľadu, ani množstvo vody. Krivka medzi kvapalným a plynným skupenstvom sa nazýva krivka nasýtenej pary alebo krivka vyparovania. Reprezentuje tlak nasýtenej pary látky pri danej teplote. Ako som uviedol vyššie, tlak nasýtenej pary je zároveň aj atmosférický tlak, pri ktorom za danej teploty nastane var. Krivka vyparovania teda reprezentuje aj vzťah medzi teplotou varu a atmosférickým tlakom.
Krivka medzi pevným a plynným skupenstvom sa nazýva sublimačná krivka. Funguje analogicky ako krivka vyparovania (čiže tiež na princípe nasýtenej pary). Tieto tri krivky sa stretávajú v jednom bode, ktorý sa nazýva trojný bod. Je to jediný bod (jediná kombinácia tlaku a teploty), pri ktorom sú v rovnováhe všetky tri skupenstvá.
Ako vidno z diagramu, zmenu skupenstva možno dosiahnuť dvomi spôsobmi - zmenou teploty a zmenou tlaku. V pravom hornom rohu si můžete všimnúť takzvaný kritický bod. Je reprezentovaný kritickým tlakom a kritickou teplotou. Nad kritickou teplotou látka už nemôže byť v kvapalnom skupenstve, nech ju akokoľvek stláčame (ak by sme teda daný plyn chceli skvapalniť, museli by sme ho ochladiť pod kritickú teplotu). Ak prekročíme aj kritický tlak aj kritickú teplotu, dostaneme fázu, ktorá sa volá nadkritická tekutina. Nadkritická tekutina nie je ani plyn, ani kvapalina, je to niečo medzi (a to sa týka jej vetkých fyzikálnych vlasntostí - jej hustota, farba a iné veličiny budú mať pri nej hodnotu niekde medzi hodnotou v kvapalnom a v plynnom skupenstve).
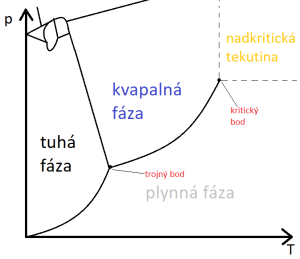 Krivka topenia/tuhnutia sa môže štiepiť na viac kriviek, vytvárajúc viac stavov (fáz) v oblasti tuhého skupenstva. Kvapalné aj plynné skupenstvo majú len jednu formu. Látka v tuhom skupenstve ale môže mať viac foriem, reprezentovaných jednotlivými oblasťami, ktoré vytvára štiepaca sa krivka. Z chémie viete, že uhlík existuje vo forme grafitu, diamantu, fullerénov a ďalších modifikácií. Že existuje biely, červený a čierny fosfor. V prípade chemických prvkov sa takéto formy naývajú alotropické modifikácie a v prípade chemických zlúčenín polymorfické modifikácie. Každej alotropickej/polymorfickej modifikáci vieme priradiť niektorú zoblastí vo fázovom diagrame. Ak daná kombinácia teploty a tlaku spadá do niektorej z oblastí, látka pri tejto kombinácii teploty a tlaku bude existovať v tej forme, ktorú reprezentuje daná oblasť. Rovnako ako medzi tuhým, kvapalným a plynným skupenstvom existujú skupenské premeny (na fázovom diagrme reprezentované krivkami), tak premeny existujú aj medzi jednotlivými modifikáciami tuhého skupenstva. Sú reprezentované krivkami, na ktoré sa štiepi krivka topenia/tuhnutia. A vidno z obrázku, štiepenie krivky vytvára ďalšie trojné body.
Krivka topenia/tuhnutia sa môže štiepiť na viac kriviek, vytvárajúc viac stavov (fáz) v oblasti tuhého skupenstva. Kvapalné aj plynné skupenstvo majú len jednu formu. Látka v tuhom skupenstve ale môže mať viac foriem, reprezentovaných jednotlivými oblasťami, ktoré vytvára štiepaca sa krivka. Z chémie viete, že uhlík existuje vo forme grafitu, diamantu, fullerénov a ďalších modifikácií. Že existuje biely, červený a čierny fosfor. V prípade chemických prvkov sa takéto formy naývajú alotropické modifikácie a v prípade chemických zlúčenín polymorfické modifikácie. Každej alotropickej/polymorfickej modifikáci vieme priradiť niektorú zoblastí vo fázovom diagrame. Ak daná kombinácia teploty a tlaku spadá do niektorej z oblastí, látka pri tejto kombinácii teploty a tlaku bude existovať v tej forme, ktorú reprezentuje daná oblasť. Rovnako ako medzi tuhým, kvapalným a plynným skupenstvom existujú skupenské premeny (na fázovom diagrme reprezentované krivkami), tak premeny existujú aj medzi jednotlivými modifikáciami tuhého skupenstva. Sú reprezentované krivkami, na ktoré sa štiepi krivka topenia/tuhnutia. A vidno z obrázku, štiepenie krivky vytvára ďalšie trojné body.
Metastabilné stavy
Keď sa každá alotropická/polymorfická modifikácia nachádza v inej oblasti fázového diagramu (pri iných kombináciách teploty a tlaku), ako je možné, že si vieme položiť grafit a diamant vedľa seba? Žeby sa zrovna izbová teplota a bežný tlak nachádzali na krivke medzi týmito formami? No ale potom by stačilo trochu ohriať alebo ochladiť danú vzorku a hneď by sa už začala meniť z jednej formy na druhú, čo sa nedeje. Ako to teda bude?
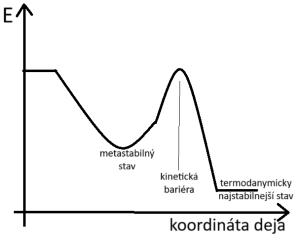 Fázový diagram popisuje skupenské stavy, ktoré sú pri daných teplotách a tlakoch najstabilnejšie (majú najnižšiu energiu). Nepopisuje však cestu, ako sa do jednotlivých stavov látka dostane. Pred najstabilnejším stavom môže ešte existovať stav, ktorý síce nemá najnižšiu možnú energiu, ale má výrazne nižšiu energiu ako všetky stavy v jeho okolí, cez ktoré by musel prejsť, aby sa dostal do najstabilnejšieho stavu. Takýto stav sa nazýva metastabilný stav. Na grafe to možno vidieť ako dolinku (metastabilný stav) pred väčšou dolinou (termodiynamicky najstabilnejší stav), medzi ktorými leží vysoký kopec (nazývaný kinetická bariéra).
Fázový diagram popisuje skupenské stavy, ktoré sú pri daných teplotách a tlakoch najstabilnejšie (majú najnižšiu energiu). Nepopisuje však cestu, ako sa do jednotlivých stavov látka dostane. Pred najstabilnejším stavom môže ešte existovať stav, ktorý síce nemá najnižšiu možnú energiu, ale má výrazne nižšiu energiu ako všetky stavy v jeho okolí, cez ktoré by musel prejsť, aby sa dostal do najstabilnejšieho stavu. Takýto stav sa nazýva metastabilný stav. Na grafe to možno vidieť ako dolinku (metastabilný stav) pred väčšou dolinou (termodiynamicky najstabilnejší stav), medzi ktorými leží vysoký kopec (nazývaný kinetická bariéra).
Fenomén existencie grafitu aj diamantu vedľa seba (čiže za rovnakých podmienok) možno teda vysvetliť tak, že pri bežných teplotách a tlakoch je síce najstabilnejší grafit, diamant je ale metastabilný.
Ďalším príkladom metastabilného stavu je takzvaná prehriata kvapalina. Kvapalina pri vare preferuje vytvárať bublinky na ostrých hranách (škrabance, nečistoty, bublinky vzduchu). Ak máte poškriabaný hrniec, tak si môžete všimnúť, že keď v ňom varíte vodu, tak bublinky sa vytvárajú práve na poškrabanom mieste. Ak je ale celý povrch zahrievanej nádoby hladký, môže sa stať, že kvapalina síce dosiahne teplotu varu, ale keďže nebude mať vhodné miesto na vytváranie bubliniek, tak namiesto vretia bude naďalej zvyšovať svoju teplotu nad teplotu varu - a toto je už stav prehriatej kvapaliny (vodu sa experimentálne podarilo pri atmosférickom tlaku zahrievať v stave prehriatej až do 200°C!). Chemici stav prehriatej kvapaliny nazývajú utajený var. Utajený var je nebezpečný, lebo prehriata kvapalina nie je stabilná (len metastabilná), a tak môže začať vrieť extrémne prudko. Na zabránenie utajenému varu sa používajú tzv. varné kamienky (kúsky keramiky, porcelánu alebo skla), ktoré vytvoria vhodný povrch pre vytváranie bubliniek.
 Opačným prípadom prehriatej kvapaliny je podchladená para. Tento stav sa dosiahne, keď sa nasýtená para ochladí, ale nemá vhodný povrch na kondenzáciu. Toto by sa dialo aj v atmosfére, nebyť drobných čiastočiek prachu a piesku, ktoré tvoria tzv. kondenzačné jadrá, a teda na nich môžu vzniknúť vodné kvapky. Takmer každá dažďová kvapka obsahuje nejaké kondenzačné jadro. Bez nich by zrážok bolo oveľa menej. Presne preto je existencia Sahary životne dôležitá. Bez nej by totiž neexistoval ani Amazonský dažďový prales. Saharský piesok je vetrom odvievaný až do oblasti pralesa, kde poskytuje dostatok kondenzačných jadier pre tvorbu zrážok v tejto vlhkej oblasti. Vďaka tomu tam môže takmer neustále pršať, čo vytvára vhodné podmienky pre rast rastlín, ktoré tak pohlcujú obrovské množstvá oxidu uhličitého a vyrábajú kyslík (preto sa Amazonský dažďový prales nazýva aj ,,pľúca našej Zeme").
Opačným prípadom prehriatej kvapaliny je podchladená para. Tento stav sa dosiahne, keď sa nasýtená para ochladí, ale nemá vhodný povrch na kondenzáciu. Toto by sa dialo aj v atmosfére, nebyť drobných čiastočiek prachu a piesku, ktoré tvoria tzv. kondenzačné jadrá, a teda na nich môžu vzniknúť vodné kvapky. Takmer každá dažďová kvapka obsahuje nejaké kondenzačné jadro. Bez nich by zrážok bolo oveľa menej. Presne preto je existencia Sahary životne dôležitá. Bez nej by totiž neexistoval ani Amazonský dažďový prales. Saharský piesok je vetrom odvievaný až do oblasti pralesa, kde poskytuje dostatok kondenzačných jadier pre tvorbu zrážok v tejto vlhkej oblasti. Vďaka tomu tam môže takmer neustále pršať, čo vytvára vhodné podmienky pre rast rastlín, ktoré tak pohlcujú obrovské množstvá oxidu uhličitého a vyrábajú kyslík (preto sa Amazonský dažďový prales nazýva aj ,,pľúca našej Zeme").
 Analogicky existuje aj podchladená kvapalina a prehriata tuhá látka. A tiež tzv. presýtený roztok, ktorý môže vzniknúť z nasýteného roztoku (roztoku obsahujúceho maximálne rozpustné množstvo rozpustenej látky) po jeho ochladení. Pri nižšej teplote je aj rozpustnosť nižšia, a teda by mali začať vypadávať kryštály. Ak ale chýba vhodný povrch, tak kryštalizácia nenastane, a máme tu stav presýtenia. Na princípe presýteného roztoku fungujú aj ohrievacie vankúšiky na ruky. Vnútri takéhoto vankúšika je trihydrát octanu sodného (H3CCOONa•3H2O), voda a pliešok. Po vložení vankúšika do horúcej vody sa trihydrát octanu sodného rozpustí. Po jeho vytiahnutí a opätovnom ochladní ale octan nevykrištalizuje, keďže chýba vhodné jadro - dosiahneme stav presýteného roztoku. Po ohnutí plieška sa na ňom otvoria póry, ktoré tvoria vhodný povrch pre kryštalizáciu, a teda octan začne prudko kryštalizovať. Kryštalizácia trihydrátu octanu sodného je exotermický proces, a tak sa začne z vankúšika uvoľňovať teplo.
Analogicky existuje aj podchladená kvapalina a prehriata tuhá látka. A tiež tzv. presýtený roztok, ktorý môže vzniknúť z nasýteného roztoku (roztoku obsahujúceho maximálne rozpustné množstvo rozpustenej látky) po jeho ochladení. Pri nižšej teplote je aj rozpustnosť nižšia, a teda by mali začať vypadávať kryštály. Ak ale chýba vhodný povrch, tak kryštalizácia nenastane, a máme tu stav presýtenia. Na princípe presýteného roztoku fungujú aj ohrievacie vankúšiky na ruky. Vnútri takéhoto vankúšika je trihydrát octanu sodného (H3CCOONa•3H2O), voda a pliešok. Po vložení vankúšika do horúcej vody sa trihydrát octanu sodného rozpustí. Po jeho vytiahnutí a opätovnom ochladní ale octan nevykrištalizuje, keďže chýba vhodné jadro - dosiahneme stav presýteného roztoku. Po ohnutí plieška sa na ňom otvoria póry, ktoré tvoria vhodný povrch pre kryštalizáciu, a teda octan začne prudko kryštalizovať. Kryštalizácia trihydrátu octanu sodného je exotermický proces, a tak sa začne z vankúšika uvoľňovať teplo.