Zloženie látok: atómy, molekuly, ióny
Ľudia sa už oddávna pokúšali zistiť, z čoho sú zložené predmety, ktoré ich obklopujú. Postupne prenikali dovnútra látok a odhaľovali ich tajomstvá.
Atómy
Atóm je najmenšia častica chemického prvku, ktorá je nositeľom jeho vlastností. Čo je vo vnútri atómov? Sú prázdne? Nie! Atóm sa skladá z jadra a obalu. V jadre sú elektricky kladne nabité častice - protóny(p+) a častice bez elektrického náboja - neutróny(n0). V obale sú elektricky záporne nabité častice - elektróny(e-). Počet protónov a elektrónov je v atóme vždy rovnaký, a preto je atóm elektricky neutrálna častica.
Elektróny
Elektróny v obale obiehajú takou veľkou rýchlosťou, že nikdy nemožno určiť ich polohu na miesto a čas. No nie sú usporiadané chaoticky, ale vo vrstvách-orbitáloch. Týchto vrstiev môže byť maximálne 7. V prvej vrstve môžu byť maximálne 2 elektróny, v druhej vrstve maximálne 8 elektrónov. Ďalšia vrstva sa začne plniť, až keď je predchádzajúca vrstva maximálne zaplnená. Prvky sú umiestnené v periodickej tabuľke prvkov tak, že ich perióda(riadok v tabuľke) udáva počet elektrónových vrstiev a ich skupina(stĺpec v tabuľke) udáva počet valenčných elektrónov - elektrónov v poslednej(valenčnej) vrstve. Prvok hélium je výnimka, pretože hoci sa nachádza v VIII.A skupine, má len 2 valenčné elektróny.
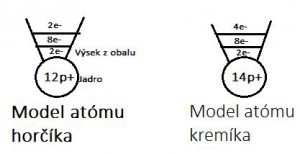
Modely atómov
Na základe vyššie uvedených vedomostí vieme nakresliť extrémne zjednodušený model atómu.
Nakresli model atómu horčíka, ktorý má 12 protónov: 1.Nakreslíme si jadro, do ktorého napíšeme 12p+. 2.Nakreslíme si prvú vrstvu, do ktorej napíšeme 2e-. 3.Nakreslíme si druhú vrstvu do ktorej napíšeme 8e-. 4.Nakreslíme si tretiu vrstvu, do ktorej napíšeme zvyšné elektróny(čiže 12-2-8=2, a preto 2e-).
Nakresli model kremíka ktorý je v tretej perióde a štvrtej A skupine: 1.Nakreslíme si prázdne jadro. 2.Nakreslíme si 3 prázdne elektrónové vrstvy. 4.Do poslednej vrstvy napíšeme 4e-. 5.Keďže ďalšie vrstvy musia byť maximálne zaplnené, do druhej napíšeme 8e- a do prvej 2e-. 6.Do jadra si napíšeme počet protónov, ktorý sa rovná počtu všetkých elektrónov(čiže 4+8+2=14, a preto 14p+).
Molekuly
Atómy sa môžu spájať(zlučovať) do väčších častíc, ktoré sa nazývajú molekuly. Z molekúl je zložená väčšina látok.
Prvky obsahujú rovnaké atómy, ktoré sa môžu zlučovať do molekúl. Napríklad molekuly kyslíka, vodíka, dusíka a halogénov sú zložené z dvojatómových molekúl(H2, O2, N2, F2, Cl2, Br2, I2). Prvky môžu byť zložené aj z trojatómových a viacatómových molekúl. Napríklad molekula síry je zložená z ôsmych atómov(S8).
Zlučovať sa môžu aj atómy rôznych prvkov, pričom vznikajú molekuly zlúčenín. Najjednoduchšie sú z nich dvojprvkové zlúčeniny. Príkladom dvojprvkovej zlúčeniny je voda(H2O). Zlúčeniny môžu byť zložené aj z troch alebo viacerých prvkov. Trojprvková zlúčenina je napríklad kyselina dusičná(HNO3). Zlúčenina obsahuje zlúčené atómy dvoch alebo viacerých prvkov. Zloženie molekúl sa vyjadruje značkami prvkov a číslami. Číslica ktorá sa píše vpravo za značkou prvku dolným indexom, udáva počet atómov jednotlivých prvkov v molekule: molekula vodíka - H2(2 atómy vodíka), molekula ozónu - O3(3 atómy kyslíka), molekula vody - H2O(2 atómy vodíka a jeden atóm kyslíka), molekula oxidu uhličitého - CO2(jeden atóm uhlíka a dva atómy kyslíka). Zápis zloženia molekúl sa nazýva chemický vzorec. Vo vzorci číslo 1 za značkou prvku(čiže keď je atóm daného prvku v molekule jeden) vynechávame. Vzorec molekuly môže predstavovať jednu molekulu, ale aj veľa molekúl. Počet molekúl(väčší ako 1) sa vyjadruje číslom pred vzorcom(napríklad 3H2O - 3 molekuly vody).
Ióny
Každý atóm sa snaží naplniť si valenčnú vrstvu na maximum. Preto, keď sa stretne s ďalším atómom, buď prijme, alebo odovzdá svoje valenčné elektróny. Aby ste to lepšie pochopili, ukážem vám reakciu sodíka s chlórom: Sodík má 3 elektrónové vrstvy, na valenčnej je 1 elektrón. Chlór má 3 elektrónové vrstvy, na valenčnej je 7 elektrónov. Vzhľadom na to, sodík odovzdá 1 elektrón chlóru. Oba atómy "budú spokojné" pretože: 1.Tretia vrstva sodíka zanikla, pretože na nej neostal žiaden elektrón, a tak sa valenčnou stala druhá vrstva, ktorá samozrejme bola maximálne zaplnená. 2.Chlór prial 1 elektrón, a tak sa jeho valenčná vrstva maximálne zaplnila.
Akonáhle atóm prijme alebo odovzdá elektróny, už to nie je atóm, lebo už nie je elektricky neutrálny, ale kladne alebo záporne nabitý. Stal sa z neho ión. Ión je elektricky kladne alebo záporne nabitá častica, ktorá vznikla z atómu odovzdaním alebo priatím elekrónu. Kladne nabitý je vtedy, keď odovzdal elektróny. Kladne nabitý ión sa nazýva katión. Záporne nabitý je vtedy, keď prial elektróny. Záporne nabitý ión sa nazýva anión.
Nábojové a oxidačné čísla
Počet priatých alebo odovzdaných elektrónov sa vyjadruje nábojovým číslom. Nábojové číslo sa vo vzorci píše nad značku prvku, ktorý tvorí ión(napríklad Na1+Cl1-. Môže byť kladné alebo záporné. Kladné vyjadruje počet odovzdaných elektrónov, záporné počet priatých elektrónov. Znamienko sa píše vždy až za číslicu. Nábojové číslo je vždy arabské. Ak má ión náboj 1+ alebo 1-, 1 môžeme vynechať a napísať len + alebo -.
No existujú aj viacprvkové zlúčeniny. Ión môže vzniknúť aj z viacerých atómov. Ako každému atómu určiť, koľko elektrónov prial alebo odovzdal? Slúži nám na to oxidačné číslo. Tiež môže byť kladné alebo záporné. Na odlíšenie od nábojového čísla je vždy rímske a znamienko píšeme pred číslicu. Číslicu I nemôžeme vynechať, ale môžeme vynechať znamienko +. Súčet oxidačných čísel v jednom katióne alebo anióne je nábojové číslo. Súčet oxidačných alebo nábojových čísel v celom vzorci sa rovná nule.
Elektronegativita
Prečo v reakcii sodíka s chlórom odovzdá sodík 1 elektrón chlóru a nie chlór 7 elektrónov sodíku? Odpoveď je taká, že sodík patrí medzi alkalické kovy a tie majú oveľa menšiu schopnosť priťahovať elektróny. Ale ako schopnosť priťahovať elektróny vyjadríme? Slúži nám na to veličina elektronegativita. Elektronegativita je schopnosť atómu priťahovať elektróny iného prvku. Pre kovy však platí, že elektróny nemôžu priať, ale iba odovzdať, a preto s prvkom, ktorý má nižšiu elektronegativitu ani nereagujú.
Chemická väzba
Chemická väzba sú súdržné sily, ktoré pôsobia medzi atómami v molekulách a iónmi v kryštáloch. Poznáme tieto druhy chemických väzieb: iónová, kovalentná, kovová, vodíková, Van der Waalsove sily. V tomto príspevku je bližšie vysvetlená len iónová a kovalentná väzba.
Iónová väzba
Keď v reakcii sodíka s chlórom sa sodík stal katiónom a chlór aniónom, získali opačné náboje. Opačné náboje sa priťahujú. A tak je v chloride sodnom sodík s chlórom spojený. Ale nevznikli molekuly. Jeden atóm sodíka pritiahol tri atómy chlóru a jeden atóm chlóru pritiahol tri atómy sodíka. Tým vznikla sieť striedajúcich sa prvkov v zlúčenine, ktorá pokračuje až do konca kryštálu. Podstatou iónovej väzby je priťahovanie opačne nabitých iónov. Keďže nevieme presný počet atómov sodíka a chlóru, vo vzorci ich vyjadrujeme pomerom(pomer vyjadrujú čísla za značkou prvku); v tomto prípade je ten pomer 1:1, takže jednotku môžeme vynechať a vzorec bude NaCl. Ale napríklad soľ chlorid vápenatý bude CaCl2; pomer je 1:2 (jednotku za Ca sme vynechali).
Kovalentná väzba a štruktúrne vzorce
Kovalentnú väzbu tvorí spoločný elektrónový pár. Delí sa na polárnu a nepolárnu. Úplne nepolárna je v molekulách tvorených z atómov jedného prvku. Môže byť jednoduchá, dvojitá, alebo trojitá.
Kreslíme ju pomocou štruktúrnych vzorcov. Medzi značky prvkov si nakreslíme čiary. Jedna čiara-jednoduchá väzba, dve čiary-dvojitá väzba, tri čiary-trojitá väzba. Ostatné valenčné elektróny kreslíme pomocou čiar, ktoré nespájajú značky(každá taká čiara-2e-). Napríklad molekula fluóru(7 valenčných elektrónov), molekula dusíka(5 valenčných elektrónov), molekula eténu(uhlíkC-4valenčné elektróny, vodíkH-1valenčný elektrón):

Ako určiť chemickú väzbu
Určujeme pomocou rozdielu elektronegativít atómov prvkov, medzi ktorými chceme typ chemickej väzby určiť. Ak je rozdiel elektronegativít väčší ako 1,7 tak je to iónová väzba. Ak je medzi 1,7 a 0,4 tak je to kovalentná polárna väzba. Ak je menší ako 0,4 tak je to kovalentná nepolárna väzba. Vzhľadom na to, že elektronegativity atómov jedného prvku v molekule budú rovnaké, ich rozdiel bude 0, a tak bude väzba čisto kovalentná nepolárna.