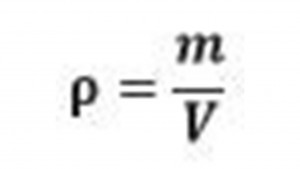Chemické výpočty
Pri výpočtoch v chémii sa používajú tieto fyzikálne veličiny:
| Veličina(a jej značka) | Jednotka(a jej značka) | Vzorec |
|---|---|---|
| Hmotnosť (m) | Kilogram(kg)-hlavná, v chémii sa používa gram(g) | Táto veličina je základná. |
| Objem (V) | Meter kubický(m3)-hlavná, v chémii sa používa centimeter kubický(cm3) alebo decimeter kubický-liter(dm3-l) | Rôzne, podľa útvaru. |
| Hustota (ρ) | Kilogram na meter kubický(kg/m3)-hlavná, v chémii sa používa gram na centimeter kubický(g/cm3). |
|
| Hmotnostný zlomok (w) | Bez jednotky, udáva sa v percentách(%) alebo v desatinných číslach | 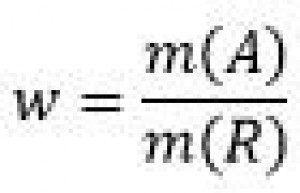 |
| Látkové množstvo (n) | Mól (mol) | Táto veličina je základná. |
| Molárna hmotnosť (M) | Gram na mól (g/mol) | 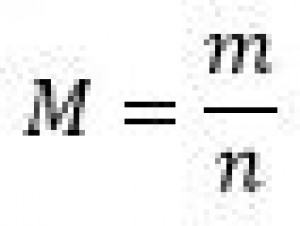 |
| Koncentrácia látkového množstva (c) | Mól na decimeter kubický (mol/dm3) | 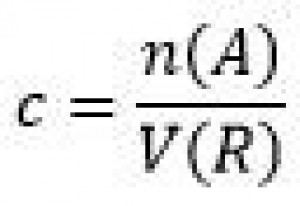 |
Hustota
Hustota je fyzikálna veličina vyjadrujúca hmotnosť látky za určitého objemu. Jej značkou je grécke písmeno ró(ρ)Základnou jednotkou je síce kilogram na meter kubický(kg/m3), ale používanou jednotkou je gram na centimeter kubický(g/cm3). Premena medzi týmito jednotkami: g/cm3=kg/m3:1000 a kg/m3=g/cm3∙1000. Kilogram na meter kubický sa zapisuje aj ako kilogram krát meter na mínus tretiu(kg•m-3) a gram na centimeter kubický sa zapisuje aj ako gram krát centimeter na mínus tretiu(g•cm-3).
Hustotu vypočítame tak, že hmotnosť(v gramoch) vydelíme objemom(v centimetroch kubických). Z toho nám vyplýva tento vzorec: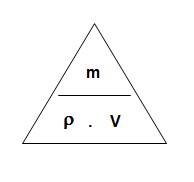
Ak si chcem z takéhoto vzorca odvodiť vzorec na výpočet jednej z týchto veličín, zakryjem si ju a zvyšok trojuholníkového vzorca tvorí vzorec na výpočet danej veličiny.
|
Zadanie: 500 mililitrov vody váži 499 gramov. Akú hustotu má voda? Zápis:
Vzorec a výpočet:
Odpoveď: Voda má hustotu 0,998 g/cm3. No v chemických výpočtoch sa to často zaokrúhľuje na 1g/cm3. |
|
Zadanie: Hustota medi je 8960kg/m3. Aký objem bude mať medený drôtik z hmotnosťou 10g? Zápis:
Vzorec a výpočet:
|
|
Zadanie: Hustota kryptónu je 3,44kg/m3. Koľko bude vážiť 3,5m3 kryptónu? Zápis:
Vzorec a výpočet:
Odpoveď: 3,5m3 kryptónu bude vážiť 12,04kg. |
Hmotnostný zlomok
Hmotnostný zlomok je veličina používaná na vyjadrovanie zloženia roztokov. Jeho značka je w. Nemá jednotku. Vyjadruje, aká časť z hmotnosti roztoku rozpustená látka, pričom celý roztok má hodnotu 1, a preto hmotnostný zlomok musí mať hodnotu menšiu ako 1. Vyjadruje sa desatinným číslom alebo percentami.
Hmotnostný zlomok vypočítame tak, že hmotnosť rozpustenej látky[jej značka je m(A)] vydelíme hmotnosťou celého roztoku[jej značka je m(R)]. MUSÍ nám vyjsť číslo menšie ako 1 a môžeme ho premeniť na percentá(vynásobením číslom 100).
Z vzorca hmotnostného zlomku vyplýva tento trojuholník:
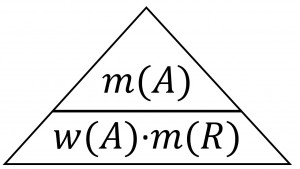
A v tomto trojuholníku znamená rozpustená látka(pri výpočtoch sa nahrádza jej vzorcom). R v tomto trojuholníku znamená roztok.
|
Zadanie: Vo vode sme rozpustili 50g kuchynskej soli. Celý roztok má hmotnosť 627g. Koľko percentný je tento roztok? Zápis:
Vzorec a výpočet:
Odpoveď: Roztok je 7,97 percentný. |
|
Zadanie: Aká bude hmotnosť roztoku NaBr, ktorého hmotnostný zlomok je 0,25 a na jeho prípravu sme použili 15g NaBr. Zápis:
Vzorec a výpočet:
Odpoveď: Hmotnosť roztuku bude 60g. |
|
Zadanie: 750g pramenitej vody Rajec obsahuje 0,04% rozpustených solí. Koľko gramov rozpustených solí táto voda obsahuje? Zápis:
Vzorec a výpočet:
Odpoveď: Pramenitá voda Rajec obsahuje 0,3g rozpustených solí. |
Avogadrova konštanta a látkové množstvo
Pri chemických výpočtoch aj zápisoch chemických reakcií(chemických rovníc) niekedy potrebujeme vedieť, o aké množstvo látky ide. Dalo by sa to počítať na atómy alebo molekuly, ale to je veľmi nepraktické. Keď ideme do obchodu kúpiť mak, tiež si nepýtame počet zrniečok, ale chcené množstvo maku vyjadrujeme pomocou fyzikálnej veličiny-hmotnosti
V chémii máme tiež veličinu, ktorá vyjadruje počet atómov v látke. Táto veličina sa nazýva látkové množstvo. Značka látkového množstva je n a jeho jednotka je mól(značka tejto jednotky je mol). 1 mól obsahuje približne 6,022•1023 častíc. Toto číslo sa nazýva Avogadrova konštanta. Vyjadrené normálnym číselným zápisom vyzerá takto: 602 200 000 000 000 000 000 000. A vyjadrené slovným zápisom to je šesťstodvatriliárd dvestotriliónov. Jeden mól je približne v osemnástich mililitroch vody.
Molárna hmotnosť (relatívna atómová hmotnosť)
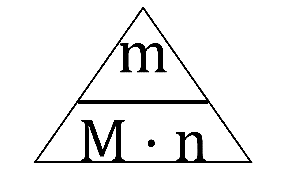
Rovnaké látkové množstvo rôznych látok má rôznu hmotnosť. Je to preto, lebo atómy, ktoré majú viac protónov, sú aj ťažšie. Na vyjadrenie konštantnej hmotnosti látky nám slúži veličina molárna hmotnosť(relatívna atómová hmotnosť). Jej značka je M a jej jednotka je gram na mól(g/mol). Niekedy sa táto jednotka zapisuje aj ako gram krát mól na mínus prvú(g•mol-1) Molárnu hmotnosť akejkoľvek vypočítame tak, že hmotnosť látky vydelíme látkovým množstvom, ktoré táto látka obsahuje.
No málokedy potrebujem vypočítať molárnu hmotnosť vydelením hmotnosti látkovým množstvom. Molárna hmotnosť sa využíva ako pomocná veličina, čiže nie ju sa snažím vypočítať, ale sa snažím vypočítať iné veličiny pomocou nej.
A kde molárnu hmotnosť vyhľadám? Pre prvky je uvedená v periodickej tabuľke. Pre zlúčeniny si ju viem vypočítať. Vypočítaj molárnu hmotnosť kyseliny sírovej: 1.Vzorec kyseliny sírovej je H2SO4. Z neho vyplýva, že jedna molekula obsahuje dva atómy vodíka, jeden atóm síry a štyri atómy kyslíka. 2.Vyhľadám si teda molárnu hmotnosť vodíka, síry a kyslíka. M(H)=1,01g/mol M(S)=32,07g/mol M(O)=16g/mol 3.Spočitam všetky molárne hmotnosti. Prvky, ktoré sa v zlúčenine nachádzajú viackkrát, započítam viackrát. M(H2SO4)=2M(H)+M(S)+4M(O) M(H2SO4)=2•1,01g/mol+32,07g/mol+4•16g/mol=98,09g/mol.
Pri výpočtoch odvodených od molárnej hmotnosti(hmotnosť, látkové množstvo) vieme použiť tento trojuholníkový vzorec:
|
Zadanie: Molárna hmotnosť vodíka je 1,01g/mol, kyslíka 16g/mol. Koľko mólov vody obahujú 2 kilogramy vody? Zápis:
Vzorec a výpočet: Najprv vypočítame molárnu hmotnosť vody:
Potom vypočítame látkové množstvo vody:
Odpoveď: 2 kilogramy vody obsahujú 110,99878 mólov vody. |
|
Zadanie: Molárna hmotnosť zlata je 196,97g/mol. Akú hmotnosť bude mať 14,25mol zlata? Zápis:
Vzorec a výpočet:
Odpoveď: 14,25mol zlata má hmotnosť 2806,8225g. |
|
Zadanie: Akú molárnu hmotnoť má héliu, keď jeden jeho gram obsahuje 0,25mol častíc? Zápis:
Vzorec a výpočet:
Odpoveď: Molárna hmotnosť hélia je 4g/mol. |
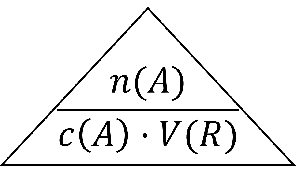
|
Zadanie: Molárna hmotnosť chloridu sodného je 58,44g/mol. Vo vode sme rozpustili 15 gramov chloridu sodného . Celý tento roztok má objem 500 mililitrov. Aká je koncentrácia chloridu sodného v tomto roztoku? Zápis:
Vzorec a výpočet: Najprv vypočítame látkové množstvo chloridu NaCl:
Potom vypočítame koncentráciu NaCl v roztoku:
Odpoveď: Koncentrácia chloridu sodného v tomto roztoku je 1,2835mol/dm3. |
|
Zadanie: Vypočítaj látkové množstvo hydroxidu sodného potrebného na prípravu 500cm3 jeho vodného roztoku s koncentráciou 0,2mol/dm3. Zápis:
Vzorec a výpočet:
Odpoveď: Látkové množstvo hydroxidu sodného je 0,1mol. |
|
Zadanie: V liehu sme rozpustili 4 móly jódu. Koncentrácia tohto roztoku je 2mol/dm3. Aký objem má tento roztok? Zápis:
Vzorec a výpočet:
Odpoveď: Roztok má objem 2 dm3. |